
导 语
睡眠作为人类生命活动的基本需求,近年来被公认为影响公共健康的核心要素。美国心脏协会已将睡眠健康纳入“生命八要素”框架,世界卫生组织与欧洲神经病学学会也强调睡眠对脑健康的关键作用。然而,传统研究多聚焦单一睡眠特征(如失眠或睡眠时长),缺乏对睡眠多维度共现模式及其协同健康效应的系统性评估。此外,现有研究主要依赖主观报告数据,难以客观捕捉睡眠节律性、规律性等关键维度。
尽管睡眠健康的多维性已被理论模型(如RU-SATED)提出,但以下问题仍未解决:如何通过客观监测数据(如加速度计)量化多维睡眠健康的真实世界模式?多维睡眠异常是否具有协同致病效应?其关联的疾病谱系有多广泛?哪些环境与遗传因素驱动多维睡眠异常?这些发现能否转化为临床干预靶点?
2025年7月31日,宾夕法尼亚大学Xiaoyu Li课题组在Nature Communications发表题为Health risks and genetic architecture of objectively measured multidimensional sleep health的研究论文。研究基于英国生物银行(UK Biobank)85,233名参与者的加速度计数据(覆盖587,152人夜),构建了首个整合睡眠时序、效率、时长、节律性和规律性的多维睡眠健康标志物——不利睡眠特征谱(USP)。
研究发现,USP(占人群18.9%)与76种疾病风险显著相关,涵盖心血管疾病(HR=1.35)、2型糖尿病(HR=1.31)等慢性病及感染性疾病。环境分析揭示低社会经济地位(OR=1.23)和肥胖(OR=1.94)是USP的主要驱动因素;全基因组测序鉴定出MEIS1常见变异和TTC1罕见编码变异与USP相关。该研究为睡眠健康的精准评估提供了客观标准,并为通过改善睡眠模式预防多重疾病提供了分子靶点。

正 文
研究团队首先从加速度计数据中提取26项睡眠特征,通过探索性因子分析(EFA)识别出5个核心维度:时序(入睡/觉醒时间)、效率(实际睡眠占总卧床时间比)、时长(总睡眠时间)、节律性(昼夜活动振幅稳定性)和规律性(每日睡眠模式波动)。潜在剖面分析(LPA)进一步将人群分为"有利睡眠谱"(81.1%)和"不利睡眠谱"(USP,18.9%)。USP表现为夜间型作息(平均入睡时间延迟1.2小时)、低效率(<80%)、短睡眠(<6小时)、弱节律性(昼夜振幅降低30%)及高不规律性(日间波动增加50%)。
为验证USP的健康风险,团队开展表型组关联研究(PheWAS),平均随访7.9年发现:USP显著增加心力衰竭(HR=1.35)和房颤(HR=1.18)风险,可能与昼夜节律紊乱导致自主神经失调有关;2型糖尿病风险升高31%,机制上涉及睡眠碎片化对胰岛素敏感性的损害;偏头痛(HR=1.42)和步态异常(HR=1.38)风险上升,提示睡眠-觉醒周期对神经功能的调控作用。值得注意的是,USP与视力丧失(HR=1.75)和下肢骨折(HR=1.37)等非传统睡眠相关疾病也存在显著关联,可能源于昼夜节律紊乱导致的维生素D代谢异常和跌倒风险增加。
通过全基因组测序分析,团队发现MEIS1基因内含子变异(rs113851554)与USP相关(P=3.2×10⁻⁹),该基因此前已知调控不安腿综合征;TTC1基因的蛋白截断变异通过聚集效应影响USP(P=1.5×10⁻⁶),其编码蛋白与生物钟调控因子CRY2互作。环境分析显示,冬季(OR=1.15)、低教育水平(OR=1.23)和吸烟(OR=1.64)显著增加USP风险,而婚姻状态(OR=0.70)具有保护作用。孟德尔随机化分析进一步证实USP对肝功能异常(β=0.21)和焦虑障碍(β=0.18)可能存在因果影响。
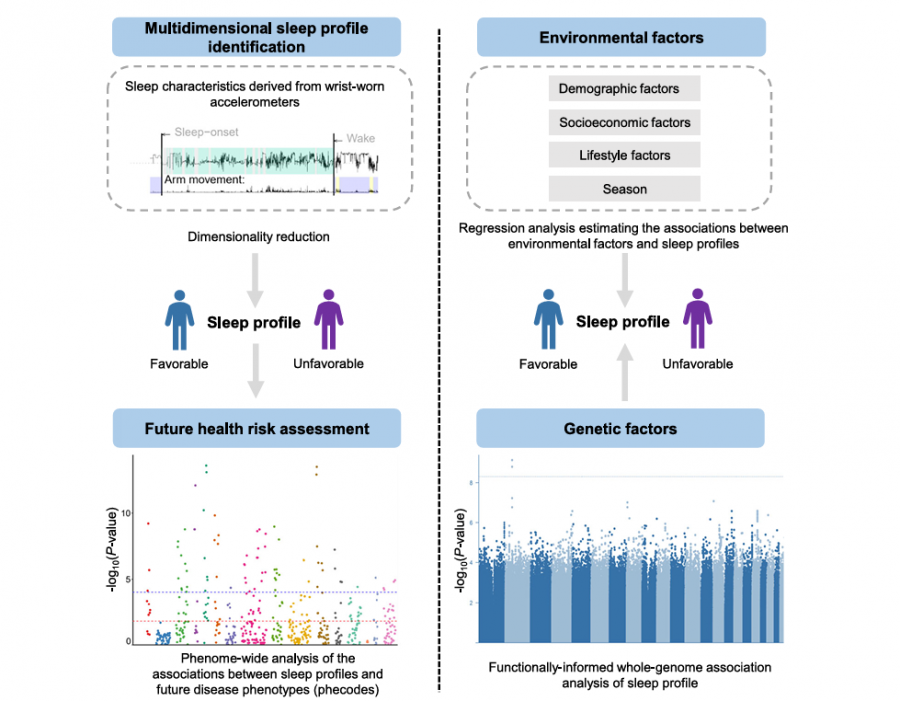
人睡眠特征识别与健康风险评估研究设计
总结
该研究首次通过大规模客观数据建立了多维睡眠健康评估框架,其创新性体现在:整合加速度计与机器学习,突破传统问卷的局限性;USP的疾病归因分数(PAF)显示,消除USP可预防5.7%的全因死亡和9.3%的心血管死亡;MEIS1和TTC1变异为开发针对睡眠节律的精准干预策略提供新方向。未来研究需在年轻人群和长期监测中验证USP的预测效能,并探索基于USP分层的个性化睡眠干预方案。
论文链接:
https://www.nature.com/articles/s41467-025-62338-0
原标题:Nature Communications | 宾夕法尼亚大学Xiaoyu Li揭示客观测量的多维睡眠健康特征及遗传基础
本文转载于微信公众号:优在生物(ID:gh_f2ce7cabda2c),转载引用请注明原出处