
睡眠,对于维持生物体的生理健康和认知功能至关重要。长期以来,科学家们致力于揭示睡眠的奥秘,尤其是其内稳态调节机制 —— 即生物体如何根据先前的清醒状态调整随后的睡眠量和深度,以确保生理功能的恢复和平衡。这一过程的核心在于识别并理解那些能够感知睡眠需求、积累睡眠压力,并最终触发恢复性睡眠的神经回路和分子机制。
丘脑,作为大脑中信息传递的关键枢纽,其内部多个核团在睡眠调节中扮演着重要角色。特别是丘脑核团(RE),其广泛的连接性和多样的功能特性,使其成为研究睡眠调节机制的热点区域。未定带(zona incerta, ZI)作为一个位于丘脑下方的复杂脑区,近年来也被发现与多种行为状态,包括睡眠-觉醒周期,有着密切的联系。ZI 中的特定神经元群体能够响应不同的生理和环境刺激,进而调节行为输出,但其如何与丘脑等脑区相互作用以调控睡眠的具体机制尚不完全清楚。
2025 年 6 月 19 日,来自约翰 · 霍普金斯大学神经学系的 Mark N. Wu 教授在 Science 上发表了题为「Sleep need–dependent plasticity of a thalamic circuit promotes homeostatic recovery sleep」的研究性文章,该研究主要探讨了丘脑回路中与睡眠需求相关的可塑性如何促进内稳态恢复性睡眠。

图 1:Science
睡眠受到内稳态机制的严格控制,长时间清醒后,动物会进入持续、巩固且深沉的睡眠状态,即恢复性睡眠(RS)。尽管过去一个世纪对睡眠内稳态调节进行了深入研究,但其生物学基础仍然不明确。已经确定了许多促进非快速眼动(NREM)睡眠的神经元群,但具体负责睡眠需求积累的神经元簇仍不清楚。
该研究旨在识别参与睡眠需求积累和内稳态睡眠调节的神经回路。通过在小鼠大脑中进行基于解剖学和功能的神经元亚群筛选,研究人员发现丘脑核团中的一群兴奋性神经元能够驱动持续、深沉且巩固的 NREM 睡眠。这些神经元投射到多个下游的 NREM 促进核团,特别是 ZI 区域,从而构建了 RE-ZI 回路作为研究重点。
研究内容的深入探索聚焦于 RE-ZI 回路的可塑性变化及其对内稳态恢复性睡眠的促进作用。作者利用光遗传学和化学遗传学技术,对 RE 神经元进行精确操控,发现短暂激活 RE 神经元能诱导动物出现延迟的持续深沉睡眠,类似于内稳态恢复性睡眠;而在睡眠剥夺期间抑制 RE 神经元,则显著减少了随后的内稳态恢复性睡眠量、巩固性和深度。
此外,作者还观察到睡眠剥夺诱导了 RE-ZI 回路的突触可塑性变化,这些变化与随后的内稳态恢复性睡眠量密切相关,表明 RE-ZI 回路在睡眠需求积累和恢复过程中扮演了重要角色。
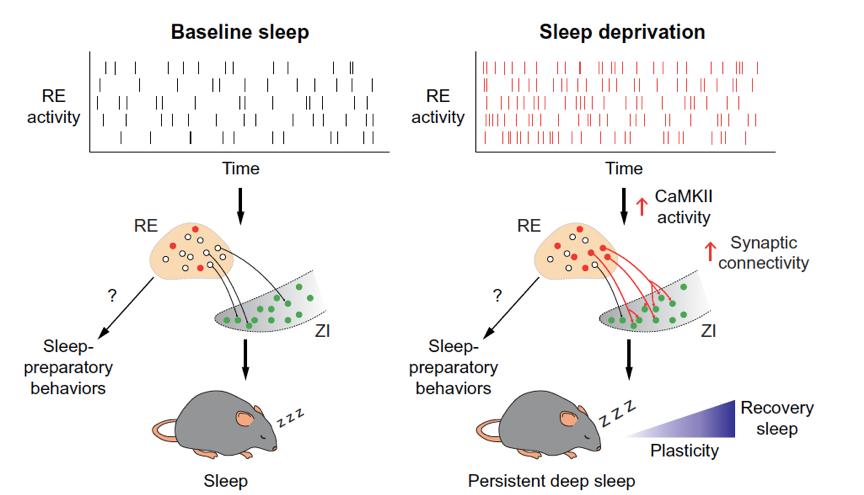
图 2: 丘脑核团与未定带间的神经回路通过睡眠需求依赖的可塑性变化促进内稳态恢复性睡眠。
最后,研究揭示了 RE-ZI 回路在睡眠内稳态调节中的关键作用,并为未来治疗睡眠障碍提供了新的思路。作者通过抑制钙/钙调蛋白依赖性蛋白激酶 II(CaMKII)活性,进一步验证了 CaMKII 在调节 RE-ZI 回路可塑性和内稳态恢复性睡眠中的关键作用。
此外,研究还提出了未来研究的方向,包括深入探索 mRE 如何调节睡眠准备行为、mRE-ZI 回路如何增加睡眠深度,以及哪些分子或细胞回路「测量」睡眠需求并激活 mRE 等,为睡眠科学领域的研究开辟了新的道路。
总之,本研究首次明确了 RE 神经元在睡眠需求积累中的作用,并展示了它们如何通过信号传递到 ZI 区域来促进内稳态恢复性睡眠。同时揭示了睡眠剥夺如何通过改变 RE-ZI 回路的突触可塑性来影响内稳态恢复性睡眠,为理解睡眠-觉醒周期的调节提供了新的视角。了解内稳态睡眠调节的神经机制可能有助于开发治疗睡眠障碍的新方法,特别是那些与内稳态睡眠调节异常相关的疾病,如失眠症和嗜睡症。
此外,2025 年 6 月 19 日,来自波士顿儿童医院神经病学系和哈佛医学院睡眠医学部的 Jonathan O. Lipton 教授对此研究进行评述,总结了 Lee 等人的研究如何揭示了丘脑中一组神经元在驱动恢复性睡眠和调节睡眠债务中的作用,为理解睡眠内稳态提供了新的视角。

图 3: Science
Jonathan O. Lipton 教授认为 Lee 等人在 Science 杂志上发表的研究发现有重要意义,丘脑中的一组神经元在睡眠剥夺期间活动增加,并促进睡眠恢复和深度。这些神经元位于丘脑的一个扩散区域,称为内侧丘脑核团(mRE),化学遗传学和光遗传学刺激这些 mRE 神经元,增加了非快速眼动(NREM)睡眠的持续时间和深度。刺激还引发了睡眠前的筑巢和梳理行为,这些行为在啮齿动物中被认为是睡眠的准备行为。
Lee 等人使用转基因小鼠线标记了睡眠剥夺期间激活的神经元,发现 mRE 中的一个特定目标区域是未定带中释放 γ-氨基丁酸(GABA)的细胞,这些细胞特异性地表达 LIM 同源框蛋白 6 基因(Lhx6)。只有 mRE-ZI 回路对于睡眠剥夺诱导的 NREM 睡眠和睡眠深度的增加是必需的。强调了该发现对于理解睡眠障碍和相关神经精神疾病(如阿尔茨海默病、精神分裂症和创伤性损伤)的潜在临床应用具有重要价值。
参考文献:
Sang S,et al. Sleep need–dependent plasticity of a thalamic circuit promotes homeostatic recovery sleep. Science. 2025 June 19.
通讯作者:
Mark N. Wu:约翰 · 霍普金斯大学神经学系,所罗门 ·H· 斯奈德神经科学系,凯维里神经科学发现研究所教授,在神经科学领域有着深厚的研究背景,专注于睡眠-觉醒调节机制的研究。该团队的研究工作得到了美国国立卫生研究院(NIH)等多家机构的资助,包括 R01NS094571、R35NS122181 等基金项目。
原标题:越睡越累?Science 揭示大脑如何偿还睡眠债
本文作者:文心,转载于微信公众号:丁香学术(ID:dingxiangshiyan),转载引用请注明原出处